Budowa materii
Uwaga: materiał w przygotowaniu...
Aby dobrze zrozumieć czym zajmuje się chemia i gdzie (o ile w ogóle) istnieje granica pomiędzy naukami takimi jak chemia, biologia, czy fizyka, musimy przyjrzeć się budowie materii tworzącej Wszechświat. Na początek proponuję film (Fig. 1), a dopiero potem nieco więcej wyjaśnień.
Fig. 1. Fragment z filmu IMAX "Cosmic Voyage" z roku 1996 (patrz: Filmweb).
Dziś wiemy, że substancje, które tworzą otaczające nas przedmioty i organizmy zbudowane są z pierwiastków, związków chemicznych i ich mieszanin. W skład otaczającej nas materii wchodzą także inne cząstki, ale o nich mówić będziemy później (Fig. 2). Pierwiastki chemiczne to najprostsze substancje, które złożone są z identycznych atomów. Związki chemiczne natomiast składają się ze związanych atomów różnych pierwiastków i mogą być rozłożone jedynie w wyniku reakcji chemicznych, o których będziemy jeszcze wiele mówić. Mieszaniny powstają natomiast poprzez zmieszanie związków chemicznych lub pierwiastków i są substancjami, które można rozdzielić przy użyciu metod fizycznych. Przyjrzyjmy się jednak w skrócie, jak wiedza ta ewoluowała na przestrzeni wieków.
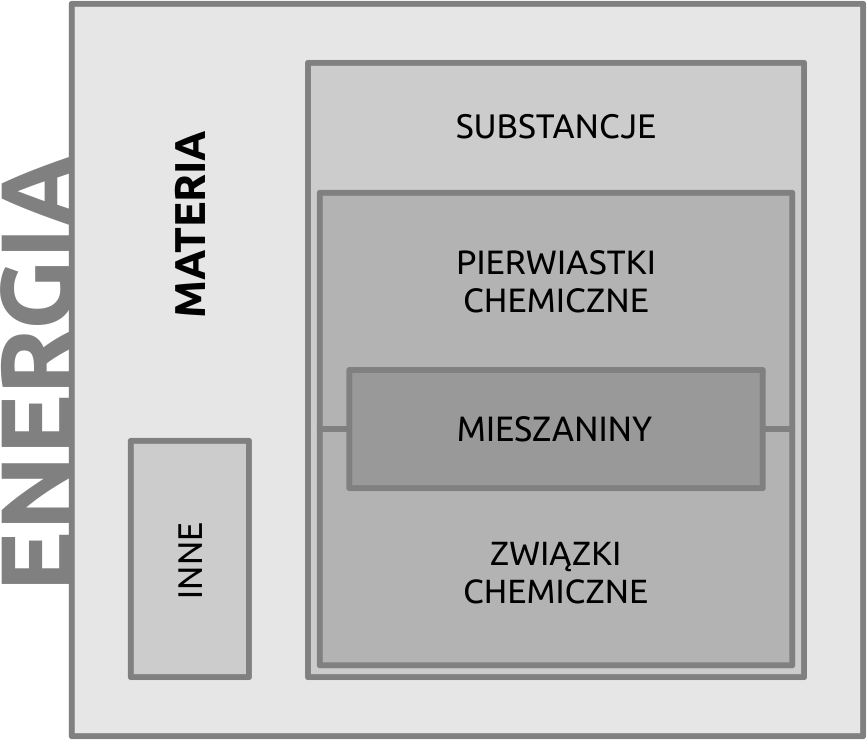
Fig. 2. Diagram przedstawiający relacje pomiędzy rożnymi składnikami materii.
Już około 450 roku p.n.e. grecki filozof Demokryt z Abdery wprowadził pojęcie atomu (gr. ἄτομος, atomos - 'niepodzielny'), jako najmniejszej, niepodzielnej cząstki tworzącej wszystko co nas otacza. Było to jednak pojęcie czysto abstrakcyjne:
Naprawdę istnieją tylko atomy i próżnia, reszta jest opinią.
Nauka wykształciła się dopiero później jako odłam filozofii. Pierwsza była fizyka (gr. φύσις, physis - 'natura'). Chemia (gr. χημεία, chemeia) jako nauka wykształciła się około XVII wieku z alchemii (ar. الکیمیاء, al-kīmīā - pochodzenie tej nazwy nie jest jednoznaczne), którą zajmowano się od starożytności, jednak dopiero w 1808 roku John Dalton opracował teorię atomistyczno-cząsteczkowej budowy materii:
Materia składa się z niepodzielnych cząstek zwanych atomami. Wszystkie atomy tego samego pierwiastka są identyczne i nie można ich stworzyć, ani zniszczyć. Atomy łączą się w prostych stosunkach tworząc cząsteczki.
Przez wiele lat uznawano niepodzielność atomu, jednak w XIX wieku udowodniono istnienie elektronów, które pochodziły "z wnętrza atomu". Z czasem wykazano również istnienie jądra atomowego i jego składników: protonów i neutronów. W XX wieku dowiedziono, że składniki jądra atomowego (tzw. nukleony) również są podzielne i składają się z cząstek nazywanych kwarkami. Bardziej szczegółowe informacje na ten temat znajdują się w artykule o atomach.
Jak widzimy pojęcie cząstki elementarnej, tego co najmniejsze, ewoluowało w czasie. Aby uniknąć nieścisłości wprowadzono pojęcie cząstek fundamentalnych, czyli tych, których nie można opisać z wykorzystaniem innych znanych cząstek. Na dzień dzisiejszy cząstki, które uznajemy za fundamentalne opisane są w tzw. modelu standardowym. W ogólności cząstki te dzielimy ze względu na posiadany przez nie spin (o spinie będziemy mówić w tomie poświęconym chemii kwantowej) na te, które mają spin ułamkowy (fermiony) i te, które mają spin całkowity lub są niego pozbawione (bozony). Wśród fermionów można wyróżnić cząstki oddziałujące silnie (kwarki) i słabo (leptony). Zestawienie wszystkich cząstek fundamentalnych tworzy specyficzny "układ okresowy" modelu standardowego, który prezentuje Tab. 1.
Tab. 1. Zestawienie cząstek fundamentalnych modelu standardowego. ■ kwarki, ■ leptony, ■ bozony cechowania, ■ bozon Higgsa.
Czy istnieją cząstki bardziej elementarne, niż te opisane w modelu standardowym? Tego na razie nie wiemy...
Atomy
Atom jest jednym z najbardziej fundamentalnych pojęć, które są w centrum zainteresowania chemików. Przyjrzyjmy się bardziej szczegółowo historii rozwoju wiedzy na jego temat.
Jak już pisaliśmy, pojęcie atomu (gr. ἄτομος, atomos - 'niepodzielny'), jako najmniejszej, niepodzielnej cząstki tworzącej wszystko co nas otacza wprowadził około 450 roku p.n.e. grecki filozof Demokryt z Abdery:
Naprawdę istnieją tylko atomy i próżnia, reszta jest opinią.
Było to oczywiście pojęcie czysto abstrakcyjne, gdyż ludzkość nie posiadała wtedy (ani długo potem) metod doświadczalnych pozwalających na badanie wewnętrznej struktury materii. Przez długi czas uważano, że materia ma budowę ciągłą. Gdy w XVII wieku zaczęła rozwijać się chemia Robert Boyle zaproponował istnienie pierwiastków chemicznych. Choć było wielu zwolenników ziarnistej teorii budowy materii, to dopiero w 1808 roku John Dalton opracował teorię atomistyczno-cząsteczkową:
Materia składa się z niepodzielnych cząstek zwanych atomami. Wszystkie atomy tego samego pierwiastka są identyczne i nie można ich stworzyć, ani zniszczyć. Atomy łączą się w prostych stosunkach tworząc cząsteczki.
Jak widać zaadoptował on termin zaproponowany przez Demokryta dla określenia pewnego rodzaju cząstek. Dalton uważał, że atomów jest tyle rodzajów, ile jest pierwiastków chemicznych. Każdemu z nich przyporządkował on symbol graficzny. Przy pomocy tych symboli zaproponował również pierwsze wzory prostych związków chemicznych.
Teorię tą pośrednio potwierdzały obserwacje poczynione w 1827 roku przez szkockiego biologa Roberta Browna. Zauważył on przez mikroskop, że umieszczone w wodzie pyłki kwiatowe znajdują się w nieustannym, chaotycznym ruchu. Ruchy te nazwano jego nazwiskiem. Podejście to pozwalało na wytłumaczenie zjawisk takich, jak rozpuszczanie się ciał stałych w cieczach, czy dyfuzja (Fig. 1).
Fig. 1. Rozpuszczanie i dyfuzja manganianu(VII) potasu w wodzie.
Przez dłuższy czas uważano, że atomy są niepodzielne i nie posiadają wewnętrznej struktury. Jednak do czasu...
Jak udowodniono podzielność atomu?
Od roku 1874 George Stoney na podstawie obserwacji procesów elektrolizy sugerował wprowadzenie pojęcia elektron (gr. ἤλεκτρον, ēlektron - 'bursztn') na określenie najmniejszej wartości ładunku elektrycznego (bursztyn był ciałem znanym z tego, że elektryzuje się podczas pocierania). Pojęcie to ostatecznie przyjęło jednak inne znaczenie...
Johann Hittorf badał wyładowania elektryczne w rozrzedzonych gazach. Skonstruował on szklaną rurę, w którą zatopił dwa metalowe druciki oraz obniżył w niej ciśnienie. W 1869 zaobserwował, że po przyłożeniu wysokiego napięcia (różnicy potencjałów) z katody wydobywa się promieniowanie.
Nieco później William Crookes opracował bardziej zaawansowaną konstrukcję, w której udało mu się uzyskać znacznie większą próżnię. Lampy takie do dziś noszą nazwę rur Crookesa (Fig. 2). W 1876 Eugen Goldstein promieniowanie powstające w takich lampach nazwał promieniowaniem katodowym (niem. Kathodenstrahlen). Natura tego promieniowania była jednak zagadkowa.

Fig. 2. Działająca rura Crookesa. a) szklana bańka z obniżonym ciśnieniem; b) katoda; c) anoda; d) wiązka promieniowania katodowego; e) metalowa przeszkoda; f) "cień" na ściance rury. Na podstawie [Wikimedia Commons: D-Kuru].
Umieszczając na drodze promieniowania katodowego niewielki wiatraczek można było zaobserwować jego ruch (Fig. 3), co świadczyło o tym, że promieniowanie to stanowił strumień cząstek o niezerowym pędzie (czyli posiadających zarówno niezerową masę, jak i prędkość: p = m v). Ponadto bieg promieniowania katodowego można było zmieniać przy pomocy magnesu lub spolaryzowanego kondensatora. Było ono przyciągane do dodatnio naładowanej okładki, zatem jego ładunek był ujemny.
Fig. 3. Prezentacja budowy rury Crookesa, tego, jak promienie katodowe odchyla się w polu magnetycznym oraz jak porusza ono wiatraczek.
Dzięki serii doświadczeń z promieniowaniem katodowym Joseph Thomson zasugerował w 1897, że promieniowanie katodowe stanowią cząstki pochodzące z wnętrza atomów, z których zbudowana była katoda. Zauważył on, że stosunek ich ładunku do masy nie zależy od materiału katody, że są one przynajmniej 1000 razy lżejsze od najlżejszego znanego atomu (wodoru). Twierdził zatem, że cząstki te są składnikiem wszystkich atomów. Ostatecznie cząstki te uznano za nośniki najmniejszej porcji ładunku elektrycznego i nazwano elektronami (zaadoptowano termin proponowany przez Stoneya).
Na podstawie swoich obserwacji Thomson twierdził, że ujemnie naładowane elektrony chaotycznie poruszają się wewnątrz dodatnio naładowanej kuli. Całość stanowić miała układ obojętny elektrycznie. Był to pierwszy model struktury wewnętrznej atomu (Fig. 4).
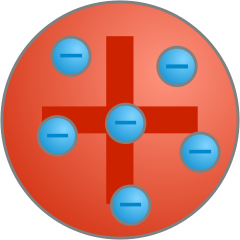
Fig. 4. Model atomu Thomsona "rodzynki w cieście".
W 1911 roku Robert Millikan rozpylał w naczyniu krople oleju, które elektryzowały się, po czym wpadały do kondensatora. Przez mikroskop obserwował on ruch kropli w polu elektrycznym. Powtarzając ten eksperyment wielokrotnie stwierdził, że ładunek zgromadzony w kroplach oleju jest całkowitą wielokrotnością pewnej najmniejszej wartości (jest skwantowany). Dzięki swojemu eksperymentowi wyznaczył on przybliżoną wartość tego ładunku, a tym samym ładunek elektronu jako 1,5924(17)·10−19 C. Dziś znamy znacznie bardziej dokładną wartość tej wielkości: 1,602176565(35)·10−19 C. Widać zatem, że błąd popełniony przez Millikana był niewielki, jednak przekracza on podane przez naukowca odchylenie standardowe.
Badaniem promieniowania katodowego zajmowało się wielu innych naukowców. Jednym z nich był Wilhelm Röntgen, który opisał inny rodzaj promieniowania, które powstaje w lampie próżniowej.
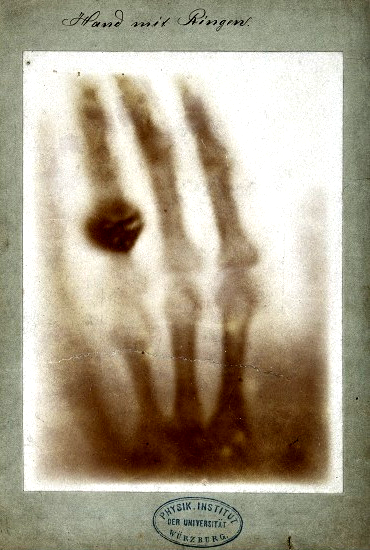
Fig. 5. Pierwsze zdjęcie rentgenowskie: dłoń żony Wilhelma Röntgena.
Pierwiastki i układ okresowy
Na początek film z piosenką o pierwiastkach:
Fig. 1. Piosenka Toma Lehrera ułożona z nazw pierwiastków do melodii z operetki "Piraci z Penzance" Williama Gilberta i Arthura Sullivana. Inne wersje: fragment występu w Kopenhadze z 1967 roku, wykonanie Daniela Radcliffe.
Pojęcie pierwiastka jako najprostszej substancji tworzącej materię wprowadził grecki filozof Arystoteles. Według niego Wszechświat tworzyły: woda, ogień, ziemia i powietrze, a resztę wypełniał eter (Fig. 2).
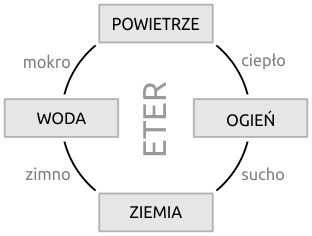
Fig. 2. Pierwiastki i zależności pomiędzy nimi wg Arystotelesa (384-322 p.n.e.).
Podobnie, jak to było w przypadku atomu, starożytne pojęcie zostało zaadaptowane. Rezygnując z filozoficznych rozważań i podpierając się doświadczeniami w 1661 roku angielski uczony Robert Boyle zaproponował współczesną definicję:
Za pierwiastki uznaję pewne pierwotne i proste, czyli chemicznie czyste substancje.
Przez długi czas nie istniała jednak ścisła definicja pierwiastka chemicznego. W tekstach z IX wieku odnajdujemy następującą informację o pierwiastkach:

Fig. 3. Jan Wolski: "Fizyka stosownie do teraźniéyszego stanu wiadomości krótko zebrana", Warszawa 1817.

Fig. 4. Zestawienie wprowadzonych przez Johna Daltona symboli pierwiastków chemicznych: 1) wodór, 2) azot, 3) węgiel, 4) tlen, 5) fosfor, 6) siarka, 7) magnez, 8) wapń, 9) sód, 10) potas, 11) stront, 12) bar, 13) żelazo, 14) cynk, 15) miedź, 16) ołów, 17) srebro, 18) platyna, 19) złoto, 20) rtęć. John Dalton: "A New System of Chemical Philosophy", Manchester 1808.
Jöns Jacob von Berzelius wprowadził stosowaną po dziś dzień symbolikę literową. Symbole tworzone były od pierwszej (lub pierwszych dwóch) liter nazwy łacińskiej pierwiastka, np. Si (łc. silicum - 'krzem').
Odpowiadając na problem postawiony na początku - nie jesteśmy w stanie jednoznacznie rozgraniczyć nauk przyrodniczych. Choć fizyka to nauka, która zajmuje się badaniem materii i energii oraz ich wzajemnymi oddziaływaniami i przemianami, to podobna tematyka, lecz w węższym zakresie, tworzy przedmiot zainteresowania chemii. Chemicy poszukują informacji na temat substancji chemicznych: tego jak zbudowane są pierwiastki i związki chemiczne oraz jak ze sobą reagują.
